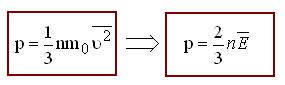
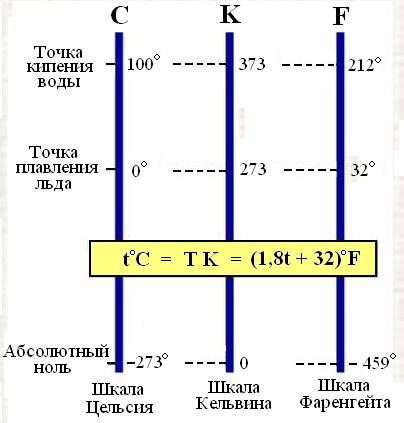
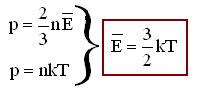
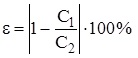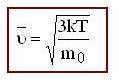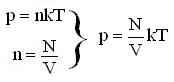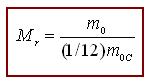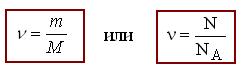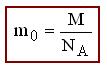Молекулярная физика – это раздел физики, в котором законы механики применяются не к каждой отдельной частице вещества, а к их совокупности. При этом используются усреднённые физические величины.
Молекулярно-кинетическая теория (МКТ) – это теория, которая рассматривает строение вещества с точки зрения трёх основных положений.
Основные положения молекулярно-кинетической теории
1. Все вещества состоят из частиц (молекул, атомов);
Атом – наименьшая частица химического элемента, которая обладает его свойствами.
Молекула – наименьшая частица вещества, которая обладает его химическими свойствами.
В состав молекулы может входить различное число атомов. Так, молекулы углерода и инертных газов одноатомны, молекулы таких веществ, как водород и азот – двухатомны, воды – трехатомны и т.д. Молекулы наиболее сложных веществ – высших белков и нуклеиновых кислот – построены из сотни тысяч атомов. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Молекула определенного вещества имеет иные физические свойства нежели само вещество. Такие свойства, как температура плавления и кипения, механическая прочность и твердость, определяются прочностью связи между молекулами в данном веществе при данном его агрегатном состоянии. Поэтому применение подобных понятий к отдельной молекуле не имеет смысла.
Плотность – это свойство, которым отдельная молекула обладает и которое можно вычислить. Однако плотность молекулы всегда больше плотности вещества (даже в твердом состоянии), потому что в любом веществе между молекулами всегда имеется некоторое свободное пространство.
Электрическая проводимость, теплоемкость, определяются не свойствами молекул, а структурой веществ в целом. Эти свойства сильно изменяются при изменении агрегатного состояния вещества, тогда как молекулы при этом не претерпевают глубоких изменений. Таким образом, понятия о некоторых физических свойствах не применимы к отдельной молекуле, но сами эти свойства по своей величине различны для молекулы и вещества в целом.
Не во всех случаях частицы, образующие вещество, представляют собой молекулы. Многие вещества в твердом и жидком состоянии, например, большинство солей, имеют не молекулярную, а ионную структуру. Некоторые вещества имеют атомное строение. В веществах, имеющих ионное или атомное строение, носителем химических свойств являются не молекулы, а те комбинации ионов или атомов, которые образуют данное вещество.
Доказательства положения:
1. Фотографии поверхности физического тела, сделанные с помощью туннельного микроскопа (был создан в середине 80-х годов сотрудниками знаменитой компьютерной фирмы IBM (г. Цюрих) Г. Биннингом и Г. Рорером, удостоенными за его изобретение Нобелевской премии);
2. Закон постоянных отношений Джона Дальтона.
Первое убедительное, хотя и косвенное, доказательство существования атомов и молекул было получено английским химиком Д. Дальтоном (1766—1844). Дальтон объяснил закон постоянных отношений. Согласно этому закону при образовании любых химических соединений массы реагирующих веществ находятся в строго определенных отношениях. Так, например, при образовании воды из водорода и кислорода отношение масс прореагировавших газов водорода и кислорода всегда равно 1:8. Этот факт становится понятным лишь в том случае, если допустить, что при образовании мельчайшей частички воды — молекулы — некоторое определенное число атомов водорода соединяется с определенным числом атомов кислорода. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Поэтому отношение масс водорода и кислорода при образовании воды должно быть равно отношению удвоенной массы атома водорода к массе атома кислорода. Это отношение не может измениться ни при каких условиях.
2. Молекулы (атомы) вещества находятся в беспрерывном хаотическом (тепловом) движении;
Характер движения зависит от агрегатного состояния вещества, а скорость – от температуры.
Доказательства положения:
Явление диффузии, броуновское движение, осмос.
Диффузия – процесс проникновения молекул одного вещества в межмолекулярные промежутки другого вследствие теплового движения частиц этих веществ.
Осмос – односторонняя диффузия через полупроницаемую перегородку (мембрану), которая отделяет раствор от чистого растворителя или раствора меньшей концентрации.
Обусловлен стремлением системы к термодинамическому равновесию и выравнивания концентрации раствора с обеих сторон мембраны. Характеризуется осмотическим давлением, которое равно избыточному внешнему давлению, которое необходимо создать со стороны раствора, чтобы прекратить осмос. Играет важную роль физиологических процессах, используется при исследовании полимеров, биологических структур. Благодаря осмосу питательные вещества и вода из пищеварительного тракта проникают в организм и непосредственно в клетки живых существ, вода из почвы проникает в корни растений и т.д.
3. Молекулы (атомы) взаимодействуют между собой, между частицами действуют силы притяжения и отталкивания;
Эти силы действуют одновременно.
На определённом расстояния между молекулами (r0) эти силы равны между собой. На расстояниях r < r0 преобладают силы отталкивания, при r > r0 – притяжения.
Доказательства положения:
Существование жидкостей и твердых тел. Силами притяжения и отталкивания молекул объясняются упругость и прочность твердых тел.
Относительная молекулярная (атомная) масса химического элемента
Для определения масс отдельных атомов принята особая единица, которая равна 1/12 массы атома Карбона (углерода). Поскольку атомы одного и того же химического элемента отличаются массой (изотопы), поэтому в таблице Менделеева значения относительных молекулярных (атомных) масс нецелые.
Относительная молекулярная (атомная) масса химического элемента Мr – это число, которое показывает, во сколько раз средняя масса его молекулы m0 (атома) больше чем 1/12 массы атома Карбона m0C, то есть
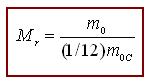
Количество вещества
Количество вещества (ν) определяется числом N структурных частиц (атомов, молекул или других частиц) в образце. [ν] = 1 моль.
Моль – это количество вещества, которое содержит столько же структурных частиц данного вещества, сколько атомов Карбона содержится в 12 г углерода.
NА = 6,02·1023 (моль-1) – постоянная Авогадро (количество атомов или молекул в 1 моле любого вещества).
Установлено, что в 12 г углерода содержится 6·1023 атомов, таким образом, 1 моль води – это 6·1023 молекул води, 1 моль Сульфура – это 6·1023 атомов серы).
Согласно закону Авогадро 1 моль идеального газа занимает при нормальных условиях объём 22,4 л/моль.
Молярная масса
Молярная масса М вещества – это величина, которая равна отношению его массы m к соответствующему количеству вещества ν; или молярная масса вещества – это масса одного моля вещества. [М] = 1 г/моль. Тогда
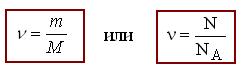
Масса молекулы m0 вещества связана с его молярной массой соотношением
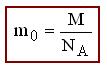
Масса тела можно выразить через массу одной молекулы и число молекул:
m = m0 N
Числовое значение молярной массы вещества совпадает с числовым значением относительной молекулярной (атомной) массой элемента.
Пример, М(CuSO4) = 64 + 32 + 4·16 = 160 г/моль; Мr (CuSO4) = 160
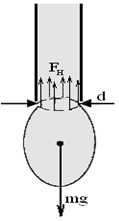
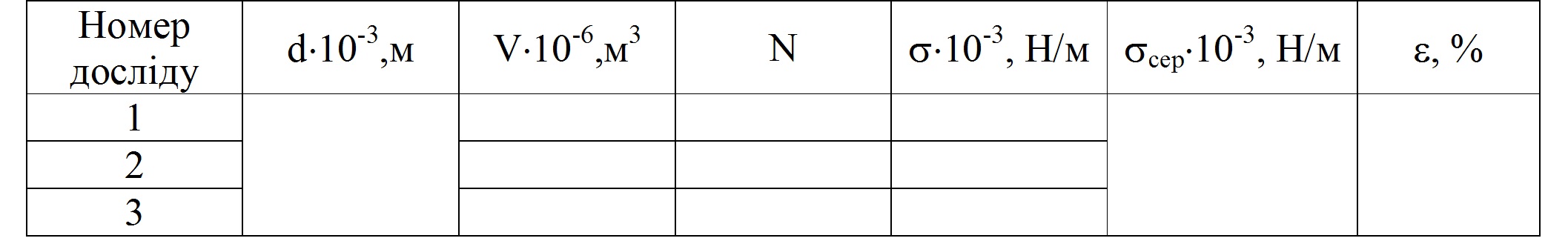
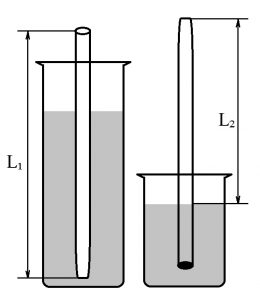
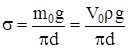 де V0 – об’єм однієї краплі, d – внутрішній диаметр трубки.
де V0 – об’єм однієї краплі, d – внутрішній диаметр трубки.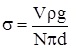
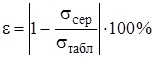 8. Зробити висновок, в якому зазначити: яку величину ви вимірювали; яким є результат вимірювання; у чому причина похибки вимірювання.
8. Зробити висновок, в якому зазначити: яку величину ви вимірювали; яким є результат вимірювання; у чому причина похибки вимірювання.