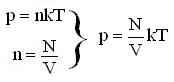Идеальный газ – это теоретическая модель газа, в котором размерами и взаимодействием частиц на расстоянии можно пренебречь. Единственное их взаимодействие – упругие столкновения.
В реальном газе присутствует взаимодействие молекул, а также молекулы имеют определённый собственный объём, которым нельзя пренебречь.
При достаточно низком давлении и высокой температуре реальный газ с достаточной степенью точности подчиняется законам идеального газа.
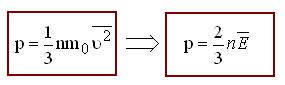
Основное уравнение МКТ (уравнение Клаузиуса)
устанавливает связь между макропараметром термодинамической системы – давлением идеального газа и характеристиками его микроскопического состояния: концентрацией, массой и скоростью молекул.
где 1/3 – множитель, который является следствием трёхмерного пространства; – средний квадрат скорости молекул газа; m0 – масса одной молекулы; ![]() – средняя кинетическая энергия поступательного движения молекул; n – концентрация молекул
– средняя кинетическая энергия поступательного движения молекул; n – концентрация молекул ![]() , где N – общее число молекул в ёмкости, V – объём ёмкости.
, где N – общее число молекул в ёмкости, V – объём ёмкости.
Температура
Температура – скалярная физическая величина, которая характеризует состояние теплового равновесия макроскопической системы.
Если два тела имеют разную температуру, то тепло передается от более нагретого тела к менее нагретому до полного выравнивания температур. Если два тела имеют одинаковую температуру, между ними не происходит теплообмен.
В молекулярно-кинетической теории температура – это мера средней кинетической энергии движения молекул, из которых состоит система.
Основное уравнение МКТ, которое выражает зависимость давления газа (р) от концентрации молекул (n) и температуры(Т):
р = n k Т
то есть при одинаковых давлениях и температурах концентрация молекул во всех газах одинаковая.
k = 1,38·10-23 Дж/К – постоянная Больцмана (связывает температуру в энергетических единицах с температурой в Кельвинах).
Из формулы следует закон Авогадро:
в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое количество молекул.
Измерение температуры основано на зависимости какой-либо физической величины от температуры. Эта зависимость и используется в температурной шкале термометра – прибора, служащего для измерения температуры.
Температура измеряется жидкостными или газовыми термометрами, которые проградуированы соответствующим образом. Высокие температуры измеряются оптическими термометрами (по спектру излучения) или электрическими (полупроводниковые термисторы, термопары).
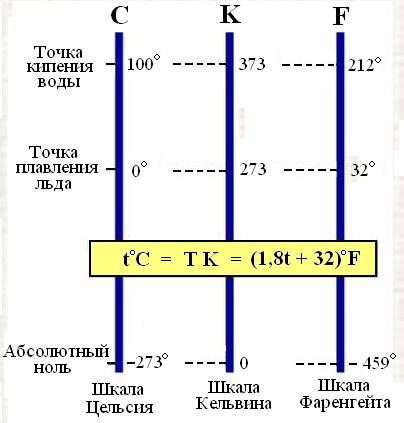
Самыми распространёнными температурными шкалами являются шкалы Цельсия, Кельвина и Фаренгейта.
Основными частями любого термометра являются термометрическое тело и шкала.
При измерении температуры следует обратить внимание на то, что:
1. Термометр фиксирует собственную температуру, которая равна температуре тела, которое находится в термодинамическом равновесии.
2. Термометрическое тело не должно быть массивным, потому что иначе температура контактирующего тела может существенно измениться.
В международной шкале температур за ноль принята температура таяния льда при нормальной атмосферном давлении; за 100°С – температура пара кипящей воды при нормальном атмосферном давлении. 1/100 этого интервала – это 1°С (Цельсия).
В термодинамической шкале температур за ноль принята температура, при которой прекратилось бы тепловое движение частиц, из которых состоит тело. Эта температура называется абсолютным нулём температур Т = 0К = –273,15°С (1К = 1°С).
Формула связи термодинамической температуры (Т) и температуры по международной шкале температур:
Т = (273, 15 + t) К t = (Т – 273,15)ºС
Из формул 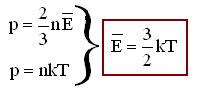 для одноатомных молекул
для одноатомных молекул
То есть температура прямо пропорциональна средней кинетической энергии поступательного движения молекул.